พันธะเคมี
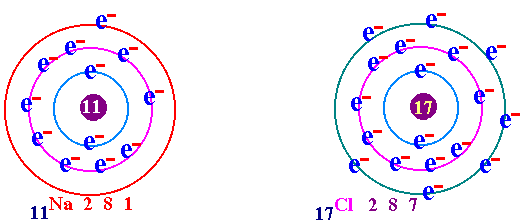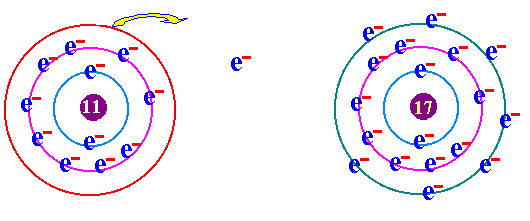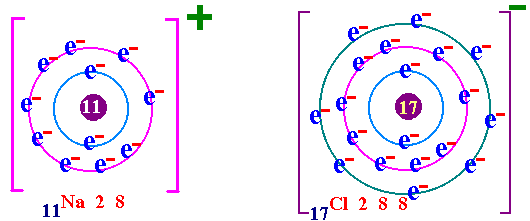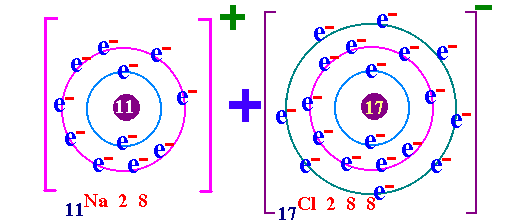
พันธะเคมี คือ แรงยึดเหนี่ยวระหว่างอะตอมกับอะตอมภายในโมเลกุล เป็นแรงยึดเหนี่ยวระหว่างอะตอมที่ทำให้เกิดโมเลกุลของสาร กฎออกเตด ( Octet rule ) จากการศึกษาเกี่ยวกับธาตุก๊าซเฉื่อย เช่น He Ne Ar Kr พบว่าเป็นธาตุที่โมเลกุลเป็นอะตอมเดี่ยว คือในหนึ่งโมเลกุลของก๊าซเฉื่อยจะมีเพียง 1 อะตอม แสดงว่าเป็นธาตุที่เสถียรมาก ทำให้นักวิทยาศาสตร์สนใจที่จะค้นคว้าถึงเหตุผลที่ทำให้ธาตุเฉื่อยมีความเสถียร และจากการศึกษาโครงสร้างอะตอมของธาตุเฉื่อยมีการจัดเรียงอิเล็กตรอนวงนอกสุดเหมือนกัน คือมี 8 อิเล็กตรอน(ยกเว้น He มี 2 อิเล็กตรอน) เช่น 2He = 2 10Ne = 2 , 8 18Ar = 2 , 8 , 8 36Kr = 2 , 8 , 18 , 8 ส่วนธาตุหมู่อื่นมีการจัดเรียงอิเล็กตรอนในระดับพลังงานชั้นนอกสุด ไม่ครบ 8 เช่น 1H = 1 6C = 2 , 4 7N = 2 , 5 8O = 2 , 6 ธาตุที่มีวาเลนต์อิเล็กตรอนไม่ครบ 8 ในธรรมชาติจะไม่สามารถอยู่เป็นอะตอมเดี่ยวๆได้ ซึ่งแสดงว่าไม่เสถียร ต้องรวมกันเป็นโมเลกุลซึ่งอาจจะมี 2 อะตอมหรือมากกว่า การที่อะตอมของธาตุต่างๆ รวมตัวกันด้วยสัดส่วนที่ทำให้วาเลนต์อิเล็กตรอนเท่ากับ 8 นี้ นักวิทยาศาสตร์ได้ตั้งเป็นกฎขึ้นเรียกว่า กฎออกเตต การรวมกันเพื่อทำให้อะตอม มีวาเลนต์อิเล็กตรอนครบ 8 อาจมีลักษณะดังนี้ อะตอมใช้วาเลนต์อิเล็กตรอนร่วมกันเป็นคู่ๆ จะเกิด "พันธะโคเวเลนต์ " อะตอม ให้หรือรับอิเล็กตรอน จะเกิดเป็น " พันธะไอออนิค " อะตอมใช้วาเลนต์อิเล็กตรอนร่วมกันทั้งก้อน จะเกิดเป็น " พันธะโลหะ " (ความแข็งแรงของพันธะ พันธะโลหะ > พันธะไอออนิค > พันธะโคเวเลนต์)